غضروف مصنوعی با کمک پرینت سه بعدی ساخته شد
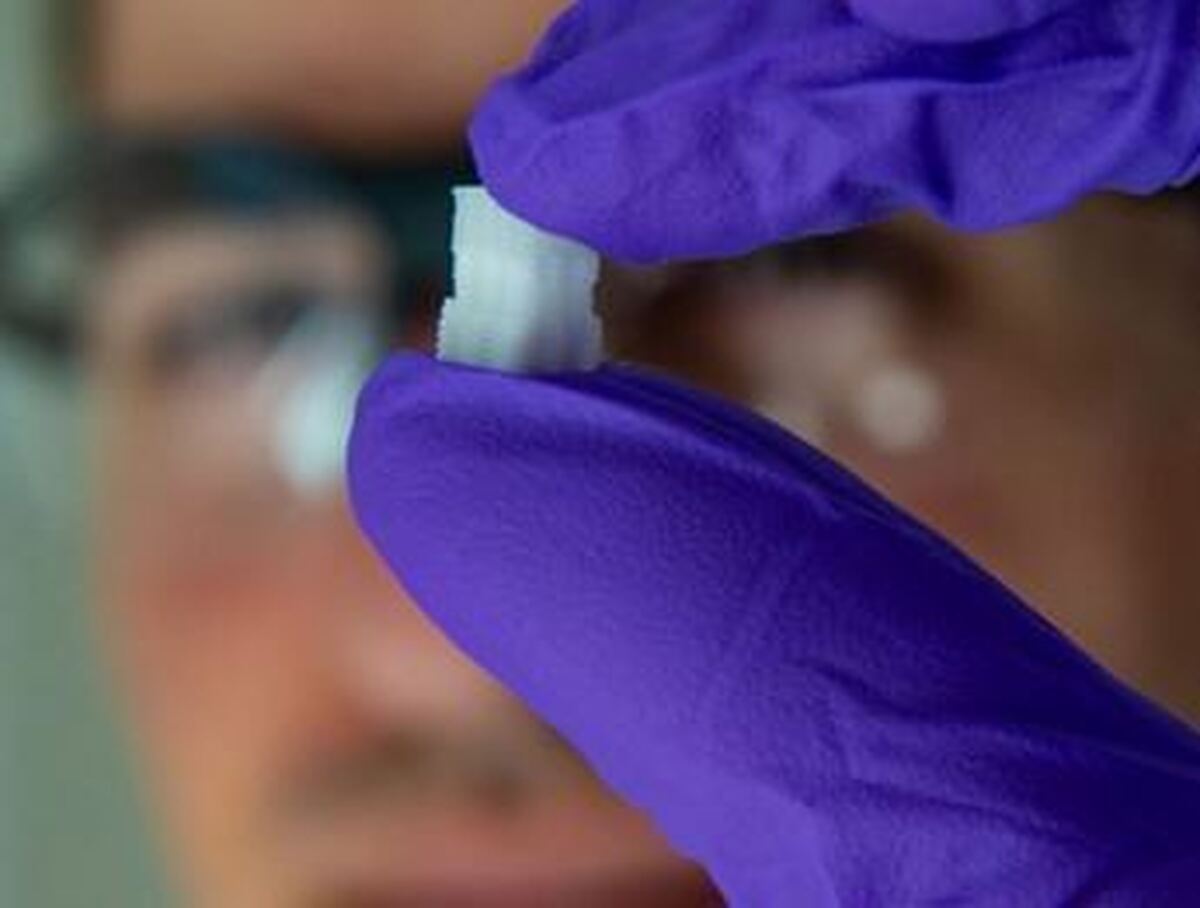
به گزارش خبرنگار «نبض فناوری» آیا برای جایگزینی غضروف آسیب دیده، امکان رشد بافت در آزمایشگاه وجود دارد؟ زیرا رشد بافت غضروف با یک رویکرد جدید در آزمایشگاه میتواند به بیماران آسیب دیده کمک کند و این مشکل را حل کند. با توجه به توانایی کرویهای سلولی (SPH) برای مونتاژ با تراکم سلولی بالا در سازههای بزرگ، استفاده از آنها به عنوان بلوکهای ساختمانی توجه زیادی را در زمینه ساخت زیستی به خود جلب کرده است. با این وجود، پس از بلوغ این ساختار، ترکیب همراه با اندازه چنین بلوکهای ساختمانی تغییر میکند و بر توانایی همجوشی آنها برای تشکیل یک ساختار بافتی منسجم با اندازه قابل کنترل تأثیر میگذارد. این پدیده طبیعی محدودیتی برای استانداردسازی درمانهای مبتنی بر اسفروئید در محیط بالینی برجای گذاشته است. در حال حاضر با استفاده از تکنیکی که به طور قابل توجهی با سایر روشهای مورد استفاده در سراسر جهان متفاوت است، گام مهمی به سمت ایجاد بافت جایگزین در آزمایشگاه برداشته شده است. در این روش ظروف کروی کوچک با یک چاپگر سه بعدی با وضوح بالا ایجاد میشوند. سپس این ظروف با سلولها پر شده و به شکل دلخواه جمع میشوند. نکته اینجاست که سلولهای ظروف مختلف به هم متصل میشوند، ظرف کشت نیز خود تجزیه پذیر است و در نهایت ناپدید میشود.
ساخت بیولوژیکی بافتها و اندامهای مبتنی بر کروییدها (SPHs)
ساخت بیولوژیکی بافتها و اندامها با استفاده از اسفروئیدها (SPHs)، که به آنها میکروبافت نیز گفته میشودکه با استفاده از برخی جنبههای زیستشناسی تکوینی آنها، به عنوان یک مسیر تکنولوژیکی امیدوارکننده پیشنهاد شده است. علاوه بر قابلیت خود مونتاژی SPHها، اشاره شد که آنها بلوکهای ساختمانی مناسب برای ساخت رباتیک و خودکار در مقیاس صنعتی را نشان میدهند. در واقع، اولین اندام کاربردی چاپ شده زیستی، یعنی غده تیروئید موش عروقی، با استفاده از این ساختارکروی ساخته شد، که منجر به پیشرفتی در زمینه چاپ زیستی شد. گزارشهای بیشتر اخیراً به امکان استفاده از SPH برای مهندسی بافت غضروفی پرداختهاند. زیرا این ساختار ها هنگامی که در تماس نزدیک قرار میگیرند، میتوانند ترکیب شوند و یک ساختار منسجم را تشکیل دهند. با این وجود، پس از خود مونتاژ، ساختارهای بافتی ساخته شده از SPHهای متعدد تحت فشرده شدن و در نتیجه کاهش حجم شدید قرار میگیرند. این پدیده طبیعی پایداری ساختارهای بافتی مهندسی شده با استفاده از روشهای بدون داربست را محدود میکند و تطبیقپذیری برای ساخت بافتهای زیستی با معماریهای سه بعدی کنترلشده را کاهش میدهد. این رویکرد به طور تجربی بر روی ساختارهای لوله مانند پایه که حلقههای عروقی را تقلید میکردند نیز تأیید شد. با این وجود، این امر به طور قابل توجهی جریان کار را پیچیده میکند: زیرا که اولاً، این کاهش حجمی نه تنها نتیجه فشردگی بافت است، بلکه در نتیجه آزاد شدن سلولهای غیرکروی اطراف ساختارهای کروی نیزهست. ثانیا، وقوع و بزرگی هر دو پدیده به عوامل زیادی بستگی دارد (به عنوان مثال نوع سلول، تراکم سلولی، درجه بلوغ SPH، مقدار ECM ترشح شده و غیره). در این مرحله، ما از هیچ مدل محاسباتی که چنین عوامل مختلفی را برای ساخت زیستی قابل پیش بینی ساختارهای پیچیده سه بعدی ادغام کند، آگاه نیستیم.
قفسهای کروی کوچک به عنوان داربست برای سلولها
Oliver Kopinski-Grünwald از موسسه علوم و فناوری مواد در TU Wien، میگوید: در این رویکرد جدید از یک فرآیند پرینت سه بعدی با وضوح بالا برای ایجاد کرههای ریز متخلخل ساخته شده از پلاستیک زیست سازگار و تجزیه پذیر استفاده میشود که با سلولها پر میشوند. سپس میتوان این کرویها را در هر هندسهای مرتب کرد و سلولهای واحدهای مختلف بهطور یکپارچه با هم ترکیب میشوند تا یک بافت زنده و یکنواخت را تشکیل دهند، قبلاً کشت سلول برای ایجاد بافت غضروفی چالش برانگیز در نظر گرفته میشد. اما باید بدانید که "کشت سلولهای غضروف از سلولهای بنیادی بزرگترین چالش نیست. مشکل اصلی این است که تودههای سلولهای بنیادی در طول زمان شکل خود را تغییر میدهند و اغلب کوچک میشوند، بنابراین شما معمولاً کنترل کمی بر شکل بافت حاصل دارید. برای جلوگیری از این امر، تیم تحقیقاتی در TU Wien با رویکرد جدیدی کار میکند: برای ایجاد ساختارهای قفسمانند کوچک، از سیستمهای چاپ سهبعدی با وضوح بالا مبتنی بر لیزر استفاده کردند، زیرا یک میلی متر آنها به عنوان یک ساختار پشتیبانی عمل میکند که بلوکهای ساختمانی فشرده را تشکیل میدهند که میتوانند به هر شکلی مونتاژ شوند. سلولهای بنیادی ابتدا در این مینی قفسهای فوتبالی شکل وارد میشوند که به سرعت حجم ریز را به طور کامل پر میکنند. پروفسور الکساندر اوسیانیکوف، رئیس بخش چاپ سه بعدی و ساخت بیولوژیک توضیح میدهد: "به این ترتیب، ما میتوانیم به طور قابل اعتمادی عناصر بافتی تولید کنیم که در آن سلولها به طور مساوی توزیع شده و تراکم سلولی بسیار بالا باشد. این امر با رویکردهای قبلی امکان پذیر نبود.
رشد کامل بافتی یکنواخت و همگن
این تیم از سلولهای بنیادی تمایز یافته استفاده کردند - یعنی سلولهای بنیادی که دیگر نمیتوانند به هیچ نوع بافتی تبدیل شوند، اما از قبل برای تشکیل یک نوع بافت خاص، در این مورد بافت غضروف، از پیش تعیین شده اند. چنین سلولهایی به ویژه برای کاربردهای پزشکی جالب هستند، اما ساخت بافت بزرگتر در مورد سلولهای غضروف چالش برانگیز است. در بافت غضروفی، سلولها یک ماتریکس خارج سلولی بسیار برجسته را تشکیل میدهند، یک ساختار مشبک بین سلولها که اغلب از رشد کرویهای سلولی مختلف با هم به روش دلخواه جلوگیری میکند. اگر کرههای متخلخل چاپشده سهبعدی با سلولها به روش دلخواه کلونیزه شوند، کرهها را میتوان به هر شکل دلخواه مرتب کرد. اکنون سؤال مهم این است: آیا سلولهای کرویهای مختلف نیز با هم ترکیب میشوند تا بافتی یکنواخت و همگن را تشکیل دهند؟ Kopinski-Grünwald میگوید: «این دقیقاً همان چیزی است که ما اکنون توانستیم برای اولین بار نشان دهیم. زیرا در زیر میکروسکوپ، میتوانید به وضوح ببینید: کرویهای همسایه با هم رشد میکنند، سلولها از یک کروی به کروی دیگر مهاجرت میکنند و بالعکس، آنها به طور یکپارچه به هم متصل میشوند و منجر به ساختاری بسته بدون هیچ حفرهای میشوند - بر خلاف روشهای دیگر که تا کنون استفاده شده است، که در آن رابطهای قابل مشاهده بین تودههای سلولی همسایه باقی میمانند. داربستهای کوچک پرینت سه بعدی به ساختار کلی پایداری مکانیکی میبخشد در حالی که بافت به بلوغ خود ادامه میدهد. در طی چند ماه، ساختارهای پلاستیکی تخریب شده و ناپدید میشوند و بافت کامل شده را به شکل دلخواه باقی میگذارند.
اولین قدم به سمت کاربرد پزشکی
در اصل، رویکرد جدید به بافت غضروف محدود نمیشود، بلکه میتواند برای ساخت انواع مختلف بافتهای بزرگتر مانند بافت استخوانی نیز استفاده شود. با این حال، هنوز چند کار وجود دارد که باید در این مسیر حل شوند - به هر حال، برخلاف بافت غضروفی، رگهای خونی نیز باید برای این بافتها در اندازهای بالاتر از اندازه مشخص گنجانده شوند. Oliver Kopinski-Grünwaldمیگوید: "هدف اولیه تولید قطعات کوچک و سفارشی بافت غضروفی است که میتواند پس از آسیب وارد غضروف موجود شود." در هر صورت، ما اکنون توانستهایم نشان دهیم که روش ما برای تولید بافت غضروفی با استفاده از میکرو داربستهای کروی، هم کار میکند و هم مزایای قاطعی نسبت به سایر فناوریها دارد.»